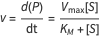Cinética de Michaelis-Menten
Para ejecutar este ejemplo necesitará
Las versiones más recientes de System Modeler y Mathematica.
Por favor haga una selección:
Obtener unaprueba gratuita Continuar
con la descarga
Introducción
La cinética de Michaelis–Menten es uno de los modelos más importantes para describir interacciones enzima-sustrato. Se utiliza para estudiar la cinética en una amplia variedad de funciones biológicas, como la respuesta inmunitaria. Mientras que un modelo de acción de masas de una interacción enzima-sustrato incluiría un paso intermedio con un complejo enzima-sustrato, la cinética de Michaelis–Menten asume que este complejo entra rápidamente en un estado cuasiestacionario y puede aproximarse. Esto elimina la necesidad de medir la tasa de formación de este complejo, lo cual es inviable en la práctica.
El modelo
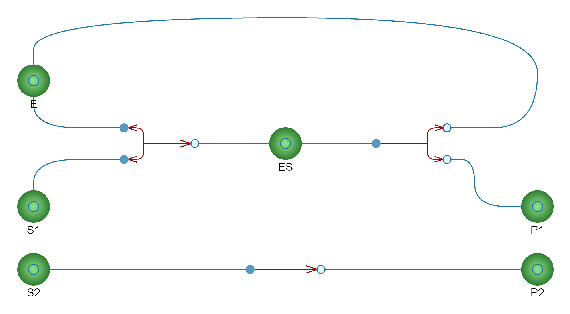
Representación visual en System Modeler
El modelo ha sido construido en System Modeler, lo que permite una representación visual del modelo.
La enzima y el complejo enzima-sustrato son implícitos en la descripción del equilibrio del el sustrato y el producto, con ayuda de la fórmula de velocidad de Michaelis–Menten.
donde
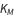 incorpora todas las constantes de velocidad
incorpora todas las constantes de velocidad
La constante de Michaelis está compuesta por las tres constantes de velocidad de reacción del modelo regular de acción de masas, formuladas para representar un flujo neto de reacción.
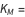
 ,
,
conocida como la constante de Michaelis, donde  ,
, 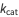 ,
, 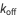 son las constantes para la unión de la enzima, la formación del producto y la disociación del sustrato, respectivamente, como se muestra a continuación.
son las constantes para la unión de la enzima, la formación del producto y la disociación del sustrato, respectivamente, como se muestra a continuación.
E+S 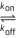
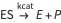
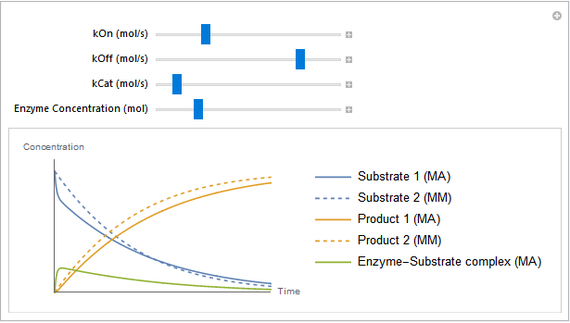
Simulación
El modelo cobra vida
Explore cómo las constantes de velocidad afectan la reacción mediante controles deslizantes dinámicos.
El modelo puede explorarse usando la función Manipulate en Wolfram Language. En el cuaderno descargable, se pueden mover los controles deslizantes y observar cómo responde el sistema.
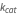 y
y 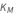 .
.Wolfram System Modeler
Probar
Comprar
System Modeler está disponible en inglés
y japonés
para Windows, macOS y Linux »
¿Preguntas? ¿Comentarios? Contacte a un experto de Wolfram »