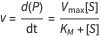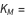Biologie informatique
Modélisez, simulez et visualisez les systèmes biologiques et biochimiques. Modélisez et simulez la cinétique des réactions.
Équation de Michaelis–Menten
Pour exécuter cet exemple, il vous faut
les dernières versions de System Modeler et Mathematica.
Veuillez choisir :
Obtenirun essai gratuit Continuer
le téléchargement
Introduction
L’équation de Michaelis–Menten est l’un des modèles les plus importants pour les interactions enzyme-substrat. Elle est utilisée pour étudier la cinétique d’un large éventail de fonctions biologiques, telles que la réponse immunitaire. Alors qu’un modèle d’action de masse d’une interaction enzyme-substrat passerait par une étape intermédiaire avec un complexe enzyme-substrat, l’équation de Michaelis–Menten suppose que ce complexe entre rapidement dans un état quasi stable et peut être approximé. Il n’est donc pas nécessaire de mesurer le taux de formation de ce complexe, ce qui n’est pas possible dans la pratique.
Le modèle
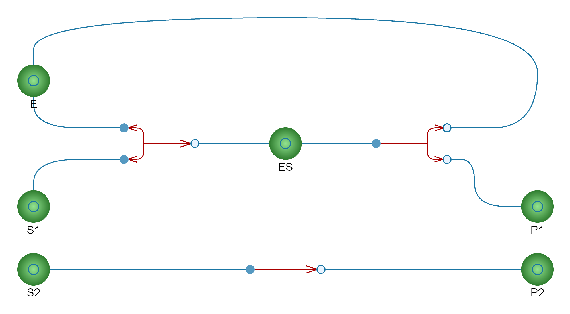
Représentation visuelle dans System Modeler
Le modèle a été construit dans System Modeler, ce qui permet d’obtenir une représentation visuelle du modèle.
L’enzyme et le complexe enzyme-substrat sont impliqués dans la description de l’équilibre entre le substrat et le produit à l’aide de la formule de taux de Michaelis–Menten.
où
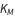 incorpore toutes les constantes de taux
incorpore toutes les constantes de taux
La constante de Michaelis est constituée des trois constantes de vitesse de réaction du modèle d’action de masse régulier, formulées pour représenter un flux de réaction net.
est appelée constante de Michaelis, où 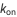 ,
, 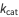 ,
, 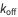 sont les constantes de liaison de l’enzyme, de formation du produit et de désolidarisation du substrat, respectivement, comme on le voit ci-dessous.
sont les constantes de liaison de l’enzyme, de formation du produit et de désolidarisation du substrat, respectivement, comme on le voit ci-dessous.
E+S 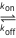

Simulation
Le modèle prend vie
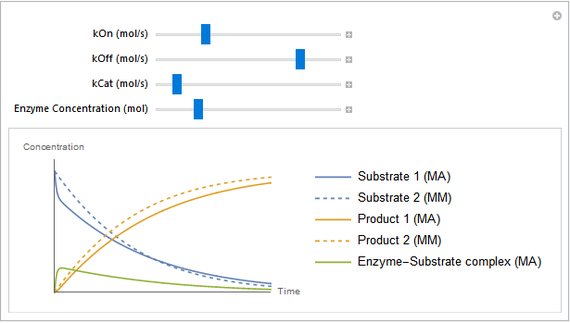
Explorez la façon dont les constantes de vitesse affectent la réaction à l’aide de curseurs dynamiques.
On peut explorer le modèle à l’aide de la fonction Manipulate dans Wolfram Language. Dans le notebook téléchargeable, vous pouvez faire glisser les curseurs et voir comment le système réagit.
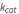 et
et 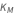 .
.Wolfram System Modeler
Essayez
Achetez
System Modeler est disponible en anglais
et en japonais
sur Windows, macOS et Linux »
Vous avez des questions ou des commentaires ? Contactez un expert Wolfram »